Гарри Израйлевич Абелев, академик, заведующий лабораторией иммунологии
Института канцерогенеза онкологического научного центра им. Н. Н. Блохина РАМН
Понять явление в науке – значит увидеть его как часть некоей общей картины, принципа или закона. Наблюдая движение или взаимодействие физических тел, мы пытаемся выразить их как конкретный случай законов механики. Попадая в незнакомую местность, мы стремимся увидеть ее в контексте целого. Встретив неизвестное животное или растение, мы вносим их в общую систему. Без этого мы не поймем, с каким отдельным случаем имеем дело.
При работе с новым белком или геном первая задача – определить, к какому суперсемейству они относятся. Это сразу же укажет и на их происхождение, и на вероятную функцию. Все, что мы видим и анализируем, выражаем в виде частного случая общих законов, когда эти законы уже установлены. В ситуациях же, когда изучаемое явление не к чему отнести, когда его координаты неизвестны и оно «висит в воздухе», его используют как окно, позволяющее заглянуть в контекст и увидеть хотя бы контур общей картины. Именно так было с антителами, послужившими своеобразным «окном» в систему иммунитета.
Токсины – антитоксины
Сейчас мы знаем, что в основе иммунитета специфического, приобретенного (в отличие от неспецифического, или врожденного) лежит принцип селекции антигенраспознающих клонов и что образование антител – частный случай реализации этого принципа [1]. Но более 100 лет назад – в 1892 г., – когда антитела были открыты, такой принцип не существовал даже в виде отдаленной гипотезы [2]. Вслед за открытием продукции дифтерийного и столбнячного токсинов, в пору повального увлечения вакцинацией, молодые сотрудники Коховского института бактериологии в Берлине Э. Беринг и С. Китазато (E. Behring & S. Kitazato) попытались иммунизировать животных против токсинов. Эксперимент сразу же удался. Сыворотка крови нейтрализовала токсины! Но что при этом появилось в крови? Дискретные вещества, нейтрализующие токсины (антитоксины), или некие измененные «коллоиды сыворотки крови»? Это оставалось неясным долгие годы. Яркий и глубокий немецкий исследователь того времени П. Эрлих (P. Ehrlich), считавший, что токсины действуют на клетки, имеющие специфические рецепторы, с тех же позиций стал рассматривать и гипотетические антитоксины, и токсины. Согласно его гипотезе, токсины действуют на клетки, содержащие на своей поверхности связывающие их рецепторы. Антитоксины, по Эрлиху, – те же рецепторы, но синтезирующиеся в избытке и попадающие в кровь, где они связывают и нейтрализуют токсин [2].
Из гипотезы следовало, что антитоксины (будущие антитела) существуют до иммунизации (до попадания токсина в организм) в клетках всех чувствительных к токсину тканей и что разные антитоксины имеют различную химическую природу. Таким образом, гипотеза Эрлиха, единственная более или менее полная, предлагала токсин–антитоксиновый контекст для интерпретации и дальнейшего анализа нового иммунологического феномена, который, надо сказать, сразу дал колоссальный клинический эффект – спасение больных дифтеритом и столбняком. И хотя гипотеза Эрлиха в то время лишь графически объясняла образование антител, она предлагала взгляд на антитела как на химические реагенты, специфически узнающие антиген и образующие с ним определенный комплекс.
Ключ к замку
В течение 30–40 лет после открытия антител их изучали независимо от гипотез о происхождении – просто как вещества сыворотки крови, реагирующие с антигеном. Такая задача не требовала общебиологических гипотез о механизмах их образования, но они, конечно, высказывались (хотя и заметного влияния на ход дела не оказывали). Факты же об антителах накапливались, влияя, естественно, и на гипотезы об их образовании. Оказалось, что антитела образуются и на нетоксические вещества и на такие совсем безвредные клетки, как, например, эритроциты других особей или других видов животных.
Самым серьезным ударом для гипотезы Эрлиха стали классические работы австрийского исследователя К. Ландштейнера (K. Landsteiner) [2, 3]. Он вводил в состав белка-носителя посредством ковалентной диазосвязи небольшую молекулу, например, динитрофенила (ДНФ) или арсаниловой кислоты (рис. 1) и иммунизировал таким конъюгатом кроликов. Полученные антитела к ДНФ-белку (анти-ДНФ) он использовал в тест-системе: анти-ДНФ + ДНФ-белок. Образование специфического осадка (реакция преципитации) подавлялась избытком ДНФ. Отсюда следовало, что антитела распознают ДНФ и реагируют с ним. Потом выяснилось, что взаимодействие анти-ДНФ с ДНФ высоко специфично и реакция подавления преципитации отличает ДНФ от три-нитрофенила (ТНФ), дифференцирует орто- и мета-ДНФ и другие группировки, введенные в белок, такие как сульфаниловая или арсаниловая кислоты. Эти малые химические группы, сами по себе не вызывающие образование антител, но приобретающие эту способность при введении в белок и определяющие специфичность комплекса, назвали гаптенами.

| Рис. 1 Антигенные детерминанты (гаптены). Слева – динитрофенил, введенный в белок (R) через ξ-аминогруппу лизина. Справа – ази-фенилсульфоновая кислота, конъюгированная с тирозином белка R |
Подобные опыты показали, что громадное количество веществ, даже не встречающихся в живой природе, приводят к появлению высокоспецифичных антител, хотя они заведомо не попадали в организм продуцента. Стало очевидным, что антитела необязательно антитоксины, что каждый антиген индуцирует антитела заново и в полном соответствии с его структурой и что они подходят друг другу, как ключ к замку. Значит, антитела не существуют до встречи с антигеном.
Эти представления позже получили название инструктивных гипотез образования антител, в которых антиген стали рассматривать как матрицу для синтеза комплементарных антител. Такие гипотезы предлагали, чтобы объяснить, как антигены инструктируют синтез антител, но биохимический механизм оставался непонятным. К началу или середине 30-х годов стало ясно, что антитела – это дискретные вещества, белки с определенным молекулярным весом, зарядом и другими физико-химическими параметрами, т.е. обладающие химической формулой. При этом их структура должна быть комплементарной структуре антигена (как упомянутый уже ключ к замку).
Матричные гипотезы
Сначала гипотезы выдвигались химиками, а сама проблема представлялась чисто биохимической. Первая гипотеза прямой матрицы предполагала, что антитела синтезируются на поверхности антигена, на которой располагаются молекулы аминокислот, сшивающихся в цепочку, комплементарную конформации антигена. Антитела должны отличаться друг от друга первичной структурой, т.е. соотношением и последовательностью аминокислот в молекуле белка. Такой взгляд на структуру и образование антител полностью соответствовало тогдашним представлениям о синтезе белка на белковой же матрице.
Однако гипотеза прямой матрицы вскоре пришла в противоречие с представлением об идентичности первичной структуры антител (т.е. последовательности аминокислот). Данные, полученные английским биохимиком Р. Портером, впоследствии нобелевским лауреатом, свидетельствовали не только о сходстве первичной структуры антител, но и об их одноцепочечном строении. И то и другое оказались неверными. Но в начале 40-х годов эти представления воспринимались как доказанные. Вскоре место первой гипотезы прямой матрицы заняла вторая.
Л. Полинг (L. Pauling) (нобелевский лауреат по химии) и Д. Кемпбелл (D. Campbell), известный иммунохимик, предположили, что до встречи с антигеном синтезируется «заготовка» для антител в виде полипептидной цепочки, не имеющей окончательной конформации. При контакте с антигеном оба конца полипептидной цепи приобретают комплементарность к небольшим участкам антигена и стабилизируются путем образования дисульфидных связей. Схему приняли с энтузиазмом – она объясняла существование огромного количества антител, возникающих на основе немногих вариантов аморфных заготовок – протоантител. Она указывала, как антиген инструктирует образование комплементарных, строго специфических антител, и соответствовала данным об идентичности первичной структуры антител и их двувалентности, равно как и распознавании антителами небольших детерминантных групп в молекуле антигена.
Авторы подтвердили свою гипотезу экспериментально, получив антитела или их подобие in vitro, – добавляя в пробирке к денатурированным прогреванием белкам сыворотки крови химический гаптен. Впрочем, данные эти в дальнейшем не воспроизводились. Таким образом, гипотеза матрицы довольно просто объясняла специфичность и разнообразие антител на основе имевшихся тогда представлений. До середины 70-х годов она оставалась наиболее простой и естественной в объяснении разнообразия и специфичности антител. Гипотеза не предполагала предсуществования антител, т.е. некоего дополнительного принципа, требующего собственного объяснения, причем явно не тривиального, и не нуждалась в существовании неограниченного количества генов, контролирующих синтез рецепторов к антителам (антител рецепторов), которые вряд ли уместились бы в геноме животного.
Напомню, что матричные гипотезы создавали химики, решая химические и биохимические задачи – определение специфичности антител и ее возникновение в процессе биосинтеза белка. Но иммунитет не только химия, он не сводится полностью к специфичности, его неотъемлемое свойство – horror autotaxis – боязнь самоотравления, по выражению Эрлиха, или, как позже сформулировал Бернет (M. Burnet), – способность отличать «свое от не своего».
Другая обязательная характеристика иммунитета – способность при повторном контакте с антигеном отвечать образованием антител быстрее, сильнее и специфичнее, чем при первом (иммунологическая память). На этом свойстве основана вакцинация, с которой и началось изучение приобретенного иммунитета. И наконец, самый «молодой» (1953) феномен – толерантность – утрата способности реагировать на данный антиген вследствие контакта его с организмом в ходе эмбрионального развития. Как можно было объяснить эти свойства матричными теориями? Какие эксперименты предлагали они для исследования иммунитета? В чем их конструктивность?
А профессионала в первую очередь интересует именно конструктивность – план эксперимента, диктуемый гипотезой и дающий ему возможность по-новому подойти к проблеме. Конструктивность нужна исследователю для повседневной работы, и он нуждается в ней даже больше, чем в объяснении известных фактов и явлений. С точки зрения профессионала, гипотеза больше оценивается по ее конструктивности, чем по объяснительной способности.
Так что же диктовали матричные гипотезы? Для каждой из перечисленных особенностей иммунитета они требовали дополнительных допущений, но общая картина была мозаичной, лишенной цельности. А эксперименты, не совместимые с ней? Гипотеза не предвидела принципиально новых экспериментов. Возник теоретический вакуум, и потребность в новом взгляде висела в воздухе.
Продукция антител
Австралийский ученый М. Бернет (M. Burnet), работавший с вирусными инфекциями и знавший иммунитет как микробиолог, эпидемиолог и медик, думал преимущественно о его биологических особенностях. Он впервые четко сформулировал проблему: как объяснить с единых позиций главные особенности иммунитета – способность отличать чужеродные макромолекулы от собственных, память и толерантность [4]. Он, вероятно, чувствовал, что за этими, казалось бы разрозненными явлениями стоит единый принцип и стремился разглядеть его под поверхностью до банальности известной феноменологии. И он вглядывался немного со стороны – не был профессиональным иммунологом, не обязан был иметь готовый ответ. Главный сдвиг в понимании проблемы, сделанный Бернетом: не матрица отвечает за особенности иммунитета, а динамика антителообразующих клеток (АОК). Как возникают эти клетки – вопрос отдельный, но раз возникнув, популяция этих клеток и ее динамика определяют всю картину иммунитета. Сохранение памяти о первичном контакте с антигеном – это сохранение потенциальных продуцентов антител; усиленный и ускоренный вторичный ответ – готовая популяция предшественников антителообразующих клеток. Отсутствие ответа на собственные антигены еще оставалось загадкой, но допускалось, что собственные антигены имеют метку «своего», освобождающую их от иммунного ответа.
Эти взгляды сформулированы в 1949 г. в монографии Бернета и Феннера «Продукция антител» (Burnet M. & Fenner F., «The production of Antibodies»), где выдвинута гипотеза непрямой матрицы: антиген каким-то образом меняет структуру или конформацию РНК (наиболее вероятную в то время матрицу для синтеза белка), которая обладает и самовоспроизводимостью, вследствие чего возникает клон клеток, синтезирующих комплементарные к антигену антитела. Гипотеза мало повлияла на ситуацию в иммунологии и не заполнила теоретический вакуум. Она не отвечала на вопрос: как и почему РНК реагирует на антиген адекватными изменениями, ведущими к синтезу антиген-специфических антител? Она не заменяла «классической» матрицы. Один тупик заменялся другим.
Выход наметился в другой, вполне независимой серии работ. Оказалось, что сродство антител к антигену варьирует чрезвычайно широко – от полного соответствия к уменьшению вплоть до сродства неспецифического глобулина. Выяснилось также, что с помощью высокочувствительных методов, например используя в качестве антигена бактериофаг*, соответствующие антитела можно обнаружить в очень малых количествах в крови неиммунного животного и до введения антигена.
|
* Инактивация бактериофагов относится к наиболее чувствительным иммунологическим реакциям. |
Возникла мысль, что в крови предсуществует весь спектр возможных антител (в ничтожно малых количествах и с низким сродством), который создается микровариантами глобулинов нормальной сыворотки. Антиген, попадая в кровь, находит свое антитело, образующийся комплекс поглощается антителообразующими клетками (тогда думали, что это макрофаги) и стимулирует продукцию данного варианта антител. Антиген отбирает наиболее аффинные антитела, и процесс повторяется, приводя и к индукции соответствующих антител, и к повышению их специфичности. Процесс иммунизации – аналог естественного отбора, а антиген – его ведущий фактор. Так вновь появилась идея о предсуществовании антител и о сути иммунизации. Идея принадлежала датскому иммунологу Н. Ерне (N. Jerne) и была опубликована в 1955 г. Ее сильная сторона заключалась в новом подходе к специфичности: высокоспецифичные антитела возникают из малоспецифичного предшественника путем «естественного отбора». В остальном – в механизме памяти и толерантности, а также в конструктивности – большого прорыва не было.
Но эта мысль была услышана Бернетом и дала недостающий толчок его представлениям [4]. Он разместил популяцию предсуществующих антител в виде рецепторов на поверхности предшественников антителообразующих клеток так, чтобы рецепторы одной специфичности были на мембране одной клетки. Одна клетка – одно антитело. Антиген, попадая в организм, находит свой рецептор на своем предшественнике АОК и стимулирует его к пролиферации, образуя клон данной специфичности. При этом специфичность антителообразующих клеток непрерывно повышается в процессе иммунизации, так как отбираются специфичные варианты, обладающие более высоким сродством к антигену. Толерантность с этой точки зрения – выпадение клонов АОК, реагирующих с антигеном в ходе эмбрионального развития. Тот же механизм ведет к отсутствию реакции на «свое» – соответствующие клоны выпадают в онтогенезе, при созревании иммунной системы.
Нужно оценить смелость гипотезы и потому, что в то время не была установлена природа ни антителообразующих клеток, ни их предшественников, еще не было показано, что антитела или их предшественники присутствуют в виде рецепторов на поверхности АОК, что антиген стимулирует пролиферацию предшественников АОК, не говоря уже о господствовавшем тогда мнении, что одна антителообразующая клетка продуцирует антитела только одной специфичности.
Взлеты и падения клональной теории
Надо ли говорить, как была встречена новая клонально-селекционная теория Бернета? С радостью – из-за возможности ее легко опровергнуть, в штыки – из-за полного несоответствия общепринятой матричной точке зрения. Она была высоко конструктивна: диктовала совершенно новые эксперименты, призванные ее полностью отвергнуть.
Первое: одна клетка – одно антитело. Не более двух. (Если структура антител определяется геном, то пара хромосом в антителообразующей клетке может контролировать два антитела.) Совершенно ново, вполне проверяемо, и если одна клетка продуцирует несколько антител – теория не проходит.
Второе: критический минимум клеток, необходимый для индукции иммунного ответа. Он должен быть не менее числа специфичностей антител, в противном случае произвольно взятый антиген не найдет предшественника АОК и не включит его в «естественный отбор».
Наконец: несколько феноменов, плохо совместимых с клонально-селекционной теорией – аутоиммунные болезни, т.е. принципиальная возможность синтеза антител против «своего», и конкуренция антигенов при иммунизации. Если иммунная система – это мозаика клонов, то как объяснить конкуренцию антигенов?
Клонально-селекционная теория, опубликованная Бернетом в 1957 г. (в развернутом виде, как монография – в 1959-м [5]), была услышана всеми, но вызвала массовое неприятие и энтузиазм, направленный на ее опровержение.
Одновременно и независимо от Бернета тот же принцип был высказан американским исследователем Д. Тэлмеджем (D. Talmage) [6]. Исследуя кривые образования антител, он увидел, что они идентичны кривым экспоненциального размножения клеточной популяции. На этом основании Тэлмедж предположил, что в основе продукции антител лежит пролиферация клона антителообразующих клеток, синтезирующих антитела определенной специфичности. Роль антигена заключается в том, чтобы найти и запустить в пролиферацию клон клеток, предназначенных к синтезу данных антител. Антигена для сохранения «памяти» уже не требуется. Правда, работа Тэлмеджа не вызвала ни положительного, ни отрицательного резонанса. Реакция иммунологического сообщества была направлена на Бернета – на опровержение его теории.
Итак, одна клетка – одно антитело. Это положение казалось наиболее уязвимым. Самые первые опыты, поставленные молодым сотрудником Бернета Г. Носселом (G. Nossel) и американским профессором Дж. Ледербергом (J. Lederberg), подтвердили гипотезу. В их опытах использовались сальмонеллы (брюшнотифозные бактерии), имеющие соматический (О) и жгутиковый (Н) антигены. Антитела к О-антигену давали агглютинацию по одному типу, а анти-Н склеивали бактерии по другому (рис. 2). Одиночные клетки селезенки, взятые от иммунизированного целыми бактериями животного и помещенные в микрокапли, которые содержали взвесь бактерий, давали агглютинацию одного типа – либо О, либо Н. Клеток, продуцирующих антитела к Н и О, авторы не обнаружили. Это был первый и притом поразительно четкий и красивый положительный результат.
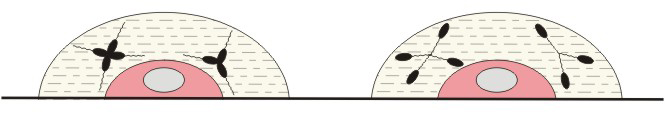
| Рис. 2 Агглютинация бактерий в микрокаплях, содержащих одну антителообразующую клетку (выделена цветом). Соматическая агглютинация антителами к О-антигену (слева) и жгутиковая к Н-антигену. |
Однако в последующие годы стали появляться данные о продукции клеткой двух или трех антител, что было несовместимо с клонально-селекционной теорией. Со временем эти результаты не подтвердились, а гипотеза «одна клетка – одно антитело» получала доказательства с разных сторон. К началу 70-х годов стало ясно, что даже при иммунизации одним белком в организме возникают антителообразующие клетки, продуцирующие антитела к различным детерминантам одной и той же молекулы. Исключения из этого правила были вызваны экспериментальными ошибками. Правда, все эти данные относились к зрелым АОК, а не к их предшественникам, постулируемым теорией Бернета. Вполне возможно, что моноспецифичные АОК возникали из полипотентных предшественников, активированных антигеном или даже одной его детерминантной группой [3].
Проблема «критического минимума» клеток, необходимых для индукции иммунного ответа, также прошла через ряд драматических этапов. Сначала сам Бернет разработал наглядную систему выявления иммунологического ответа лейкоцитов in vitro по их видимой реакции на клетки хорионаллантоисной оболочки. При реакции лейкоцитов на антигены полупрозрачной оболочки появлялись четкие бляшки. Бернет определил, сколько клеток крови донора надо, чтобы возникла бляшка у иммунологически несовместимых кур. Оказалось – 70, что по крайней мере на два-три порядка меньше, чем требовала клональная гипотеза. По расчету, необходимая для реакции с любым, произвольно взятым антигеном антителообразующая клетка должна бы присутствовать в популяции с частотой не менее 1/104–1/105. Поскольку детерминантная группа белка состоит из четырех-пяти аминокислот, предельное число сочетаний по четыре или пять из 20 дает величину, существенно меньшую (не 104–105, а соответственно 5·10³–15·10³). При меньшей частоте (а в опытах Бернета – 1/10²) гипотеза себя отвергала. Однако в этих опытах нельзя было определить, сколько антигенов участвовало в реакции (их могло быть очень много), да и частота иммунного ответа на антигены тканевой совместимости, как оказалось в дальнейшем, исключительно высока (до 1/10), что и сегодня весьма загадочно. Во всяком случае такая система для проверки клональной теории не годилась. Но самый серьезный удар был нанесен, когда in vivo, в селезенке облученных мышей, были получены клоны кроветворных клеток. Они восстанавливали иммунный ответ у тотально облученного животного. Оказалось, что смесь клеток из четырех или семи клонов восстанавливает иммунологический ответ животного на произвольно взятый антиген, т.е. четыре – семь клонов вместо постулируемых 104–105.
Эти данные были доложены на международной конференции в 1963 г., и Бернет публично отказался от своей теории, перенеся принцип селекции внутрь клетки. Конечно, такая модификация если и не сводила на нет весь смысл клонально-селекционного принципа, то существенно его обесценивала. Но данные в пользу теории продолжали накапливаться. Прямое определение числа клеток, способных реагировать с произвольно взятым меченым антигеном, соответствовало 1/104–1/105.
Иммунокомпетенция облученных животных восстанавливалась трансплантацией клеток костного мозга, селезенки или лимфатических узлов, если их количество соответствовало ожидаемому, т.е. 104–105. Удаление с помощью иммуносорбента иммунокомпетентных клеток, реагирующих на данный антиген, лишало эту популяцию способности реагировать на него, не снижая реактивность на другие антигены. Опыты моделировали и толерантность, основанную согласно теории, на выпадении предсуществующих клонов. Одним из самых результативных стал метод Еpнe, позволявший идентифицировать АОК и определять их число при ответе на антигены чужеродных в видовом отношении эритроцитов или на любые антигены, химически конъюгированные с эритроцитами. Антителообразующие клетки определялись в суспензии клеток селезенки, смешанных в геле агарозы с эритроцитами, взятыми для иммунизации. Добавление комплемента* после кратковременной инкубации приводило к гемолизу эритроцитов вокруг клеток, продуцирующих антитела. Метод Ерне позволил построить количественную кривую динамики антителообразующих клеток, которая полностью соответствовала восходящей части кривой антителообразования. Стало ясно, что эта кривая отражает динамику популяции АОК, а не интенсивность матричного (или иного внутриклеточного) синтеза антител.
|
* Система комплемента вызывает лизис эритроцитов (гемолиз), на которых фиксированы антитела. |
Признание
Итак, теория явно набирала предсказательную и конструктивную силу, несмотря на, казалось бы, сокрушительную, ниспровергающую ее аргументацию. Со временем выяснилось, что кроветворные колонии в селезенке облученных мышей образованы полипотентными стволовыми клетками кроветворной ткани на очень ранней стадии дифференцировки. Эти клетки дают предшественников всех ветвей дифференцировки кроветворной ткани, в том числе предшественников антителообразующих клеток, находящихся еще на стадии доклональной дифференцировки. Поэтому клоны стволовых клеток совсем не соответствуют клонам предшественников антителообразующих клеток, что впоследствии и подтвердилось.
Таким образом, к началу 70-х годов клонально-селекционный принцип прочно вошел в иммунологию, хотя никто не показал, что матрица или антиген не «инструктируют» синтез антител. Контуры общей теории иммунитета выразительно прорисовывались. В основу системы иммунитета легла совокупность микроклонов, отличающихся непрерывным спектром моноспецифических рецепторов, которые реагируют с любым антигеном. Роль антигена сводилась к взаимодействию с клоном, несущим комплементарный рецептор, и к стимуляции пролиферации этого клона. Это представление утвердилось к середине 70-х годов и не требовало уже специальных доказательств.
Но окончательно теория была доказана с помощью метода, позволившего получать моноклональные антитела [7]. Выяснилось, что клоны антителообразующих клеток, ранее не жизнеспособные в длительной культуре, моноспецифичны, несут на своей поверхности антительные рецепторы и существуют до встречи с антигеном. Более того, были получены гибридомы (гибриды опухолевой клетки с цитотоксическими лимфоцитами), которые также клонированы, моноспецифичны, несут на своей мембране антигенраспознающие рецепторы и существуют до встречи с антигеном. Принцип селекции клонов приобрел универсальность. Встали на свое место и плазмацитомы – опухоли антителообразующих клеток, продуцирующие строго гомогенные, моноклональные иммуноглобулины, и многочисленные лимфомы – злокачественные клоны клеток предшественников антителообразующих клеток или цитотоксических лимфоцитов.
Итак, клонально-селекционная теория иммунитета постулировала их предсуществование. Но не объясняла, как оно возникает – на основе конформационных вариантов протоантител, имеющих идентичную первичную структуру, или же отличающихся по первичной структуре, а значит – генетически? Каков генетический контроль синтеза иммуноглобулинов? Как возникают миллионы предсуществующих антител? Очевидно, эта проблема, получившая название генерации разнообразия антител, – фундаментальна для иммунологии. Несмотря на свою кажущуюся неразрешимость, она была блестяще решена и вошла в число основополагающих принципов иммунологии [8].
Литература
- Абелев Г. И. Основы иммунитета // Соросов. образоват. журн. 1966. №5. С. 4–10. (Ссылка ведет к тексту статьи в редакции 1996 года. На сайте имеется также текст с правками 2011 года)
- Ульянкина Т. И. Зарождение иммунологии. М., 1996.
- Гауровитц Ф. Иммунохимия и биосинтез антител. М., 1969.
- Бернет М. Целостность организма и иммунологические реакции. М., 1963.
- Burnet M. The clonal selection theory of acquired Immunity. Cambridge, 1959.
- Talmage D. Is this theory necessary // Immunology 1930–1980 / Ed. P. Mazumdar. Toronto, 1990. P. 67–72.
- Абелев Г. И. Моноклональные антитела (На настоящем сайте – с небольшими дополнениями и поправками 2010 года) // Соросов. образоват. журн. 1998. №1. С. 16–20.
- Энциклопедия современного естествознания. Т. II. Общая биология. Раздел «Иммунология» / Под ред. В. Н. Сойфера и Ю. П. Алтухова. М., 1999. С. 207–240.
Опубликовано в журнале «Природа» №11, 2002, с. 75–80